Cristalizarea Curs №5
Orice substanță cunoscută a poate fi în trei stări: gaz, lichid și solid. Metalele și aliajele la anumite temperaturi, de asemenea, schimbă starea de agregare: stare solidă devine lichid la temperatura de topire, o stare lichidă este gazeificat la temperatura de reflux. Temperaturile de tranziție depind de presiunea, dar la o presiune constantă, acestea sunt complet definite. Punctul de topire pentru fiecare metal este determinată și constantă.
În tranziția de la lichid la starea solidă - zăbrelele cristalină cu cristale. Acest proces se numește cristalizare.
Ceea ce explică existența de lichid la anumite temperaturi, și la alte temperaturi și de ce o conversie stare solidă are loc la temperaturi bine definite?
În natură, toate apar sau conversie spontan procese și, prin urmare, cristalizare și topire, datorită faptului că noul stat în noul mediu este energetic mai stabil, adică Acesta are un conținut mai redus de energie. (Orice sistem tinde în mod natural la un nivel minim de energie liberă).
Starea de energie a sistemului este caracterizat printr-o funcție F termodinamic, numită energia liberă (F = U-TS, gdeU- energia internă sau energia totală a sistemului, T temperatura absolută, entropie S-). Rezultă astfel că este mai mare energia liberă a sistemului, mai puțin stabil sistem, și dacă este posibil, sistemul se mută într-o stare în care energia liberă este mai mică (ca în exemplul cu mingea).
Schimbarea în condiții externe, cum ar fi temperatura, conduce la schimbarea de energie liberă. Aceste modificări au loc pe legea complexe, iar ele sunt diferite pentru ambele lichide și solide. Cu toate acestea, ea poate fi reprezentată schematic după cum urmează:
La temperatura de mai sus are o energie liberă mai mică a substanței în stare lichidă sub temperaturyTo - o substanță în stare solidă.
Evident, temperatura To. energia liberă a statelor solide și lichide sunt egale, metalul din cele două state se află în echilibru. Această temperatură Aceasta este iliteoreticheskaya Temperatura de echilibru cristalizare. Cu toate acestea, de fapt, nu poate avea loc procese de topire sau de cristalizare, așa cum pentru acest temperatureFzh = FKR.
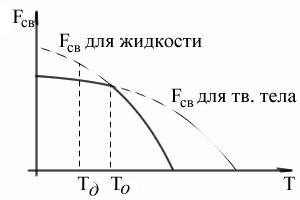
Pentru a începe cristalizarea este necesar ca procesul este favorabila termodinamic, iar sistemul a fost însoțită de o scădere a energiei libere a sistemului. Graficul arată că acest lucru este posibil numai atunci când lichidul este răcit sub fapt. Temperatura la care începe cristalizarea, practic, nazyvaetsyafakticheskoy de temperatura de cristalizare.
fluid de răcire sub temperatura de echilibru cristalizare numit subrăcire.
Transformarea inversă de cristalin la starea lichidă se poate produce, respectiv, chiar deasupra temperaturii la. Acest fenomen nazyvaetsyaperegrevom.
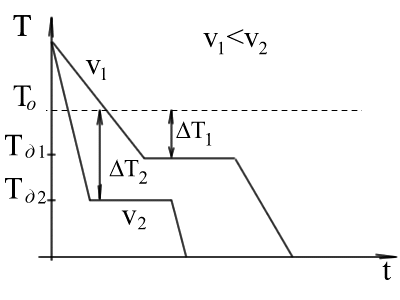
Mărimea sau gradul de subrăcire menționat diferența dintre temperaturile teoretice și cele reale de cristalizare. (Exemplu: punct de topire -Mg- 651S și Tkrf - 615S 651-615 = 36S.).
Procesul de metal de tranziție din cristale lichide pot fi reprezentate prin curbele în coordonatele de timp - temperatură.
Răcirea metalului în stare lichidă este însoțită de o scădere treptată a temperaturii și poate fi numită o răcire simplă. deoarece astfel, nu există nici o schimbare calitativă în stat.
La atingerea temperaturii de cristalizare a curbei de temperatură - timp există o platformă orizontală, deoarece disiparea căldurii degajate în timpul cristalizării compensate de căldură latentă de cristalizare. La sfârșitul anului de cristalizare, adică, după trecerea completă la o stare solidă, temperatura începe să scadă din nou, iar solidul cristalin este răcit.