Structura și funcția lor
Proteinele și structura lor.
In celulele diferitelor organisme se gaseste peste 170 de aminoacizi diferiți acizi, ci o varietate infinită de proteină creată de diferitele combinații de toți cei 20 de aminoacizi. Dintre acestea, 2 432 902 008 176 640 000 combinații, t. E. Diferite proteine, care vor avea exact poate fi formată din aceeași compoziție, dar structuri diferite. Dar acest număr imens nu este limita - proteina poate consta dintr-un număr mai mare de resturi de aminoacizi și, în plus, fiecare aminoacid într-o proteină poate să apară de mai multe ori.
Molecula de acid amino este format din două părți identice pentru toți aminoacizii, din care una este o grupare amino (-NH2), cu proprietăți de bază, celălalt - gruparea carboxil (-COOH), cu proprietăți acide. Numitul radical radical (R), la diferiți aminoacizi având o structură diferită (fig. 12).

Prezența într-o moleculă de aminoacizi și un grupări bazice, acide și determină caracterul amfoter și reactivitate ridicată. Prin aceste grupări apar la compusul de aminoacizi a formării proteinelor. In timpul reacției, o moleculă de apă este eliberată de polimerizare. iar electronii eliberați pentru a forma o legătură covalentă, numita peptidă - peptide formate (peptos Gk -. sudate). Prin carboxil liberă și o grupare amină poate fi atașat și alți aminoacizi, care se extinde „lanț“ se numește o polipeptidă. La un capăt al unui astfel de circuit va fi întotdeauna NH2 (în acest scop se numește N-end) și la celălalt capăt al - grupa COOH (acest scop se numește C-terminal) (Figura 13.).

lanțuri polipeptidice ale proteinelor sunt foarte lungi și includ o varietate de combinații de aminoacizi. Structura proteinei poate include nu una, ci două lanțuri de polipeptide și multe altele. Astfel, în molecula de insulină - cele două lanțuri și imunoglobuline sunt compuse din patru lanțuri.
Bacteriile și plantele pot sintetiza toți aminoacizii care au nevoie de substanțe mai simple. Multe animale, inclusiv la om, nu sunt capabili de a sintetiza toți aminoacizii, deci așa numiții aminoacizi esențiali (lizină, valină, leucină, izoleucină, treonină, fenilalanină, triptofan, tirozină, metionină) acestea ar trebui să primească produse alimentare ca produs finit.
Dintre proteinele distinge proteine constând numai din proteine si proteid - care conțin porțiuni neproteinică (de exemplu, hemoglobină).
În plus față de proteină simplă constând numai din aminoacizi, este de asemenea o structură complicată, care pot include carbohidrați (glicoproteine), lipide (lipoproteine), acizi nucleici (nucleoproteine) și altele.
Nivelurile de organizare a moleculei de proteină.
molecule de proteine pot lua diferite forme spatiale - conformație care reprezintă cele patru niveluri de organizare (Fig. 14).
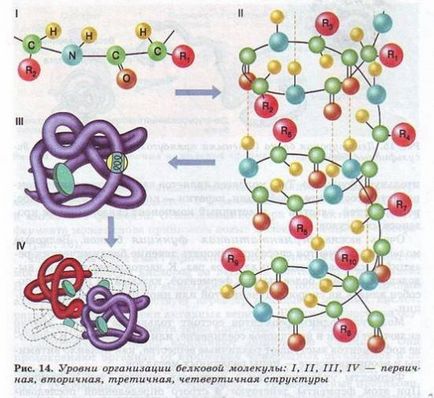
Secvența lineară de aminoacizi în lanțul polipeptidic al proteinei reprezintă structura primară. Este unic pentru fiecare proteină determină forma, proprietăți și funcții.
Structura secundară a proteinelor are loc prin formarea de legături de hidrogen între -NH2 și grupări -COOH în moduri diferite resturi de aminoacizi ale lanțului polipeptidic. Deși legături de hidrogen cu emisii reduse de rezistență, dar datorită numărului lor semnificative în combinație ele oferă o structură destul de solidă.
Structura terțiară este un fantezistă, dar pentru fiecare configurație specifică proteină având o formă bobină (globulă). Structura terțiară Durabilitate asigură ionic, bisulfura de hidrogen și (- S-S-) legături între resturile de cisteină și interacțiune hidrofobă.
Structura cuaternară nu este caracteristic pentru toate proteinele.
Ea apare ca urmare a conecta un număr de globulelor într-un set complex. De exemplu, hemoglobina umană este un complex de patru astfel de subunități.
Pierderea unei molecule de proteină la structura sa naturală numită Denaturarea. Aceasta poate avea loc sub influența temperaturii, chimicalelor, deshidratare, expunerea și alți factori. Dacă structura primară nu este rupt în timpul Denaturarea, proteina este capabil de a recrea structura (Fig. 15), pentru restabilirea condițiilor normale. Rezultă că toate caracteristicile structurii macromoleculelor de proteine este determinată de structura sa primară.
Proteinele efectua o varietate de funcții în fiecare celulă și întregul organism. Funcția proteinelor variat.
Proteinele sunt baza tuturor membranelor biologice ale organitelor celulare, astfel ele efectua structural (construcție) funktsiyu.- (Fig. 15). De exemplu, colagenul este un constituent important al tesutului conjunctiv, keratina - pene componente, păr, coarne, cuie, elastina - ligamente componente elastice, peretii vaselor de sange.
O funcție foarte importantă a proteinei enzimei.
molecule de proteine de enzime capabile să accelereze cursul reacțiilor biochimice în celulă, în sute de milioane de ori. Până în prezent, izolat și studiat peste o mie de enzime, fiecare dintre care este capabil de a influența viteza de curgere a unei anumite reacții biochimice.
Moleculele constau dintr-o enzimă numai din proteine includ proteine și alți compuși neproteice sau coenzimă ca coenzimă sunt diferite substanțe, cum ar fi vitaminele și regula anorganică - ionii de diferite metale.
Enzimele implicate în procesele de sinteză și degradare. Astfel de enzime acționează în ordine strictă, acestea sunt specifice fiecărei substanțe și accelerează numai anumite reacții. Există mai multe enzime care catalizează reacții. Selectivitatea acțiunii enzimelor asupra diferitelor substanțe chimice asociate structurii lor. Activitatea catalitică a enzimei nu este determinată de toate molecula sa și un situs particular al moleculei de enzimă care se numește centrul său activ.
Substratul reacționează cu enzima și legarea substratului se realizează în activ site-ul, forma chimică și structura site-ului activ astfel încât numai anumite molecule datorită corespondenței lor spațiale pot comunica cu ei, se potrivesc împreună „ca fiind cheia de blocare.“

În etapa finală a reacției chimice complexe „enzimă-substrat“ descompune pentru a forma produsul final și enzima liberă. Freed a centrului enzima activa din nou, poate accepta un nou material molecula substrat (Fig. 16).
Funcția de transport important de proteine.
Astfel, hemoglobina transporta oxigenul de la plamani la celulele altor tesuturi. În mușchi, această funcție este realizată de mioglobina proteine. albumină serică din sânge contribuie la transferul de lipide și acizi grași, diferite substanțe biologic active. Protein-Purtătorii efectuează transferul substanțelor prin membranele celulare. proteine specifice au o funcție de protecție. Ei protejează organismul de la invadarea organisme străine de daune. Astfel, anticorpii produși de limfocite, blocarea proteinelor străine; Interferonii - proteine antivirale universale; fibrinogen, trombină și alții proteja organismul de pierdere de sânge, formând un trombus.
Multe ființe simțitoare pentru a proteja proteine secreta numite toxine, care, în cele mai multe cazuri sunt otrăvuri puternice. La rândul lor, unele organisme sunt capabile să producă antitoxine, care inhibă acțiunea acestor otrăvuri.
Proteinele pot îndeplini funcția de energie, fiind una din sursele de energie în celulă. La clivaj plin de 1 g de proteină 17,6 kJ de energie este eliberată la produsele finale. Dar, ca o energie de proteine sursă sunt folosite foarte rar. Aminoacizii eliberați în timpul clivajul moleculelor de proteine sunt utilizate pentru a crea proteine noi.
proteine rol important in viata de celule este enormă. Biologia modernă a arătat că asemănările și diferențele dintre organisme sunt în cele din urmă determinate de un set de proteine. Mai aproape de fiecare alte organisme în poziția sistematică, cu atât mai asemănătoare proteinele lor.
Proteine. Proteine. Proteid. Peptid. legătură peptidică. Proteinele simple și complexe. Primar, structura secundară, terțiară și cuaternară a proteinelor. Denaturatsiya.1. Ce substante numite proteine? 2. Care este structura primară a unei proteine? 3. Cum să formeze structura secundară, terțiară și cuaternară a unei proteine? 4. Care este denaturarea proteinei? 5. Din ce motive proteinele sunt împărțite în simple și complexe? 6. Care sunt functiile de proteine sunt cunoscute pentru tine? 7. Care este rolul de proteine, hormoni? 8. Ce proteinele enzimei? 9. De ce proteinele sunt rareori folosite ca sursă de energie?
proteine de ou alb este tipic. Află ce se întâmplă cu ea, acționează pe ea când apa, alcool, acetonă, acid, ulei vegetal alcalin și temperatură ridicată t. D.
1. zdrobesc cartofii prime tubercul la starea de suspensie. Ia trei eprubete și fiecare a pus o cantitate mică de cartofi mărunțită.
Primul tub pus în frigider congelator, al doilea - pe raftul de jos a frigiderului, iar al treilea - borcan cu apă fierbinte (t = 40 ° C). După 30 minute, se scoate tuburile și pentru fiecare picurare cantitate mică de peroxid de hidrogen. Observați ce se întâmplă în fiecare tub. Explicați rezultatele.
Ia trei eprubete și fiecare dintre ele a pus o cantitate mică de cartofi cruzi maruntite. Primul eprubeta cu cartofi aplică câteva picături de apă, al doilea - câteva picături de acid (otet), iar al treilea - alcaline. Observați ce se întâmplă în fiecare tub. Explicați rezultatele. Trage concluzii. Enzimele sunt mult superioare altor catalizatori de specificitate, activitate catalitică și capabile să funcționeze în condiții blânde (temperatură joasă, presiune normală, etc.). Ei sunt capabili sa în câteva milisecunde pentru a asigura fluxul de reacții complexe cu mai multe etape, pentru care chimistul în laborator modern, ar dura zile, săptămâni sau chiar luni. De exemplu, o moleculă de enzimă descompune catalazei în 1 minut peste 5 milioane de molecule de peroxid de hidrogen (H2O2), care se formează în organism prin oxidarea diferiților compuși. Deoarece moleculele de proteine construite din aminoacizi, care sunt neobișnuit de mari și complexe, pentru imaginile lor folosind un simbolism convențional special. Fiecare aminoacid este indicat prin trei litere latine. Multe organisme vii sunt capabile să producă unele aminoacizi de cealaltă, și astfel încât acestea nu sunt foarte importante, aminoacizii care se gasesc in alimente bogate in proteine. Dar unele animale, inclusiv la om, ar trebui să primească un număr copleșitor de aminoacizi din alimente, deoarece numărul de aminoacizi, numite esențiale, corpul lor nu produce, dar ele sunt necesare pentru viață.