Cum se obține hidrogen din apa
Producerea de hidrogen la domiciliu proces destul de ușor și există mai multe modalități de a face acest lucru:
1. Nu trebuie să ne fie frică de soluție alcalină, deoarece aceste nume toate acestea sunt în domeniul public.
De exemplu, curățitor conductele „mole“ compoziție perfectă. Turnat într-un balon și umple ușor alcalin cu 100 ml de apă;
Se amestecă bine pentru a dizolva cristalele;
Adăugarea mai multor piese mici de aluminiu;
Va asteptam timp de aproximativ 3-5 minute, până când reacția va avea loc cât mai repede posibil;
Adăugarea mai multe piese suplimentare de aluminiu și 10-20 grame de alcali;
Se închide vasul cu un tub special rezervor care conduce într-un rezervor de colectare a gazelor și așteptați câteva minute până când aerul este eliberat sub presiunea hidrogenului a vasului.
2. Izolarea hidrogenului din sare de aluminiu și sulfat de cupru.
Balonul a se toarnă sare sulfat de cupru și un pic mai mult;
Toți se diluează cu apă și se amestecă bine;
Puneți vasul într-un rezervor de apă, deoarece reacția va fi alocată o mulțime de căldură;
În caz contrar, tot ce trebuie să faci la fel de bine ca și în prima metodă.
3. Prepararea hidrogenului din apa prin trecerea curentului prin soluție de sare de 12B în apă. Acesta este cel mai simplu mod și cele mai potrivite pentru mediul de acasă. Singurul dezavantaj al acestei metode este că hidrogenul eliberat este relativ mic.
Deci Acum, că știi cum să obțineți hidrogen din apă, și nu numai. Puteți petrece o mulțime de experimente. Nu uitați să adere la normele de siguranță, pentru a evita accidentele.
Producerea de hidrogen la domiciliu
Acest articol descrie cele mai populare metode pentru producerea hidrogenului ieftine în casă.
Metoda 1. aluminiu hidrogen și alcaline.
leșie a fost utilizat - hidroxid de potasiu sau hidroxid de sodiu. Secretata mai pură decât hidrogen în reacția acidă cu metale activă.
Turnat într-un balon o cantitate mică de hidroxid de potasiu sau de sodiu și se umple 50 până la 100 ml de apă, se agită soluția până la dizolvarea completă a cristalelor. În continuare, se adaugă câteva bucăți de aluminiu. Se începe imediat reacția cu evoluția hidrogenului și a căldurii, la început slab, dar în continuă creștere.
După ce a așteptat până când reacția va fi mai activă, se adaugă cu atenție un alt 10g. alcaline și unele bucată de aluminiu. Așa că am consolida în mod semnificativ procesul.
balon cu dop, un tub de testare cu un tub care duce la vasul de colectare a gazelor. Va asteptam pentru aproximativ 3 până la 5 minute. până când hidrogenul deplasează aerul din recipient.
Hidrogenul este generat? Pelicula de oxid care acoperă suprafața de aluminiu, în contact cu alcalii distruse. Deoarece aluminiul este din metal activ, începe să reacționeze cu apă, dizolvat în acesta, hidrogenul este eliberat.
2AL + 2NaOH + 6h3O → 2Na + 3H3 ↑
Metoda 2. Hidrogenul de aluminiu, sulfat de cupru și sare comestibile.
Balonul se toarnă puțină sulfat de cupru, și sărurile acestora. Se adaugă apă și se amestecă până la dizolvare. Soluția ar trebui să rândul său, verde, în cazul în care nu sa întâmplat, se adaugă o cantitate mică de sare.
Balonul a fost necesară pentru a pune într-o cupă umplută cu apă rece, ca reacția va fi alocată o mulțime de căldură.
Se adaugă la soluția de câteva bucăți de aluminiu. Începe reacția.
Cum este evoluția hidrogenului? Procesul produce clorură de cupru, dizolvarea pelicula de oxid cu metal. Concomitent cu reducerea cuprului are loc formarea de gaz.
Metoda 3. Hidrogenul de zinc și acid clorhidric.
Plasat in tuburi bucati de zinc si sa le umple cu acid clorhidric.
zinc ca metal activ prin interacțiunea cu un acid de dislocuit hidrogen.
Zn + 2HCl → ZnCl2 + h3 ↑
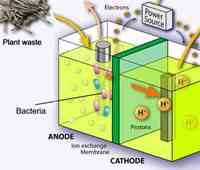
4. Metoda de producere a hidrogenului prin electroliză.
A fost trecut printr-o soluție de apă și curent electric sudate sare. Atunci când reacția este evoluat hidrogen și oxigen.
Producerea hidrogenului prin electroliza apei.

Acest model nu este potrivit pentru utilizarea de zi cu zi de înaltă calitate. Dar testa ideea nu a reușit. Așa că am decis să aplice electrozii de grafit. O sursă minunată de electrozi din grafit este curent căruciorul colector. Ele sunt pline de role de pe ultima oprire. Trebuie să ne amintim că unul dintre electrozii vor fi distruse.
Debitarea și modificați un fișier. Intensitatea electrolizei depinde de intensitatea curentului și zona electrozilor. Pentru electrozii fire atașate. Firele trebuie să fie izolate cu grijă. Modelul electrolizor de locuințe ar trebui să fie sticle de plastic fine. Capacul orificii pentru tuburi și fire. Toate de etanșare cu atenție unse.
Pentru a conecta două rezervoare potrivesc tăiat gâturile sticlelor. Acestea trebuie să fie conectate împreună și cusătură oplavit. Nuci din capace de sticlă. Cele două sticle sunt făcute în partea de jos a gaura. Totul este conectat și cu atenție umplut cu mastic.
Consumatorul va utiliza rețeaua ca o sursă de tensiune de 220V. Vreau să avertizez că este o jucărie periculoasă. Deci, dacă nu aveți abilități suficiente sau nu există nici o îndoială, este cel mai bine să nu se repete. Rețeaua de start curent alternativ, electroliză trebuie să fie îndreptate. Pentru a face acest lucru, o punte de diode se potrivesc perfect. Asta fotografia nu a fost suficient de puternic și rapid ars. Cea mai bună opțiune a fost chinez MB156 pod diode într-o carcasă de aluminiu.
Dioda pod devine foarte fierbinte. Acesta va avea nevoie de răcire activă. Cooler pentru procesorul unui calculator se potrivește perfect. Pentru caz, puteți utiliza caseta de dimensiune raspayachnuyu dreapta. Vândute în bunuri electrice.
Sub pod dioda este necesară pentru a pune câteva straturi de carton. Capacul raspayachnoy cutie din găurile necesare. Aici este instalarea ansamblului. Celula este alimentat de la rețea, ventilatorul sursei de alimentare universală. Soluția de electrolit folosit bicarbonat de sodiu. Aici trebuie amintit că, cu cât concentrația soluției, cea mai mare viteza de reacție. Dar acest lucru mai mare și de încălzire. Și aceasta contribuie la încălzirea reacției va face descompunerea sodiu la catod. Această reacție este exotermă. Ca rezultat, se va produce hidrogen și hidroxid de sodiu.
Aparatul că, în fotografia de mai sus, foarte cald. Trebuia să fie pornit periodic și să aștepte până când se răcește. Problema cu încălzirea a fost rezolvată parțial prin răcirea electrolitului. Pentru aceasta am folosit pompa pentru o fântână de desktop. Un tub lung se extinde de la o butelie la alta peste pompă și o găleată cu apă rece.
tub de conectare la minge bine pentru a oferi un robinet. Vândute în magazine pentru animale de companie în departamentul pentru acvarii.
Cunoștințe de bază de electroliză clasice.
Principiul eficienței electrolizor pentru h3 și gaze O2.
Cu siguranță toată lumea știe, dacă omiteți cele două cuie într-o soluție de bicarbonat de sodiu și se aplică pentru un alt plus de unghii și minus pe de altă parte, acesta va sta pe hidrogen roșu și oxigen în teritoriu pozitiv.
Acum, sarcina noastră este de a găsi o abordare pentru a obține cât mai mult din acest gaz, și petrece o cantitate minimă de energie electrică.
Lecția 1: Tensiune
Apa de descompunere începe atunci când se aplică la electrozi un pic mai mult de 1,8 volți. Dacă aplicați 1 volt, curentul aproape nu merge și nu iese gaz, dar atunci când tensiunea se apropie de valoarea de 1,8 volți, curentul începe să crească brusc. Aceasta se numește potențialul minim de electrod la care începe electroliza. Poetomu- dacă vom furniza 12 volți la 2 unghii - atunci un astfel de electrolizor va mânca o mulțime de energie electrică și de gaze naturale nu va fi suficient. Toată energia va intra în încălzirea electrolit.
Comanda. la electrolizor nostru a fost economică - trebuie să fie transmise nu mai mult de 2 volți per celulă. Prin urmare, dacă avem 12 volți - le-am împărți în 6 celule și de a lua pe fiecare din 2 volți.
Acum simplifica - pur și simplu împărțiți containerul în 6 părți plastinami- rezultatul este o șase celule conectate în serie este de 2 volți fiecare placă interioară pe de o parte va fi un plus pentru fiecare celulă, iar cealaltă mai puțin. Deci, - o lecție învățată numărul 1 = aplică o mică tensiune.
Acum două eficiență lecție: Distanța dintre plăcile
Cu cât distanța - cu atât mai mare rezistență, cu atât mai mult curent va cheltui pentru a obține un litru de gaz. Mai scurtă distanță - mai puțin cheltui wați pe oră pe litru de gaz. În plus, se va utiliza acest termen - indicele de eficiență electrolizor / Graficul arată că aproape plăcile sunt împreună - este mai mică tensiunea necesară pentru a trece același curent. O ieșire a gazului este cunoscută direct proporțională cu cantitatea de trecere a curentului prin electrolit.
Multiplicarea o mică tensiune peste curent - vom obține mai puține wați pentru aceeași cantitate de gaz.
Acum, a treia lecție. plăci pătrate
Dacă luăm cuiul 2 și folosind primele două reguli le aranja îndeaproape și le va depune la 2 volți - gazul ajunge foarte puțin, deoarece acestea va fi dor de un curent foarte mic. Încercați în aceleași condiții pentru a lua două plăci. Acum, cantitatea de gaz de curent și va fi crescut direct proporțional cu pătratul plăcilor.
Acum patra lecție: concentrația de electrolit
Folosind primele trei reguli ia plăci mari de fier într-o mică distanță unul de altul și ei vor oferi 2 volți. Și să-i în vodichku, adăugând un vârf de cuțit de bicarbonat de sodiu. Electroliza va merge, dar foarte lent, apa va fi încălzită. Ioni în soluție este de mare rezistență este mic, de căldură este redusă și crește cantitatea de gaz
Surse: 505sovetov.ru, all-he.ru, zabatsay.ru, xn ---- dtbbgbt6ann0jm3a.xn - p1ai, domashnih-usloviyah.ru